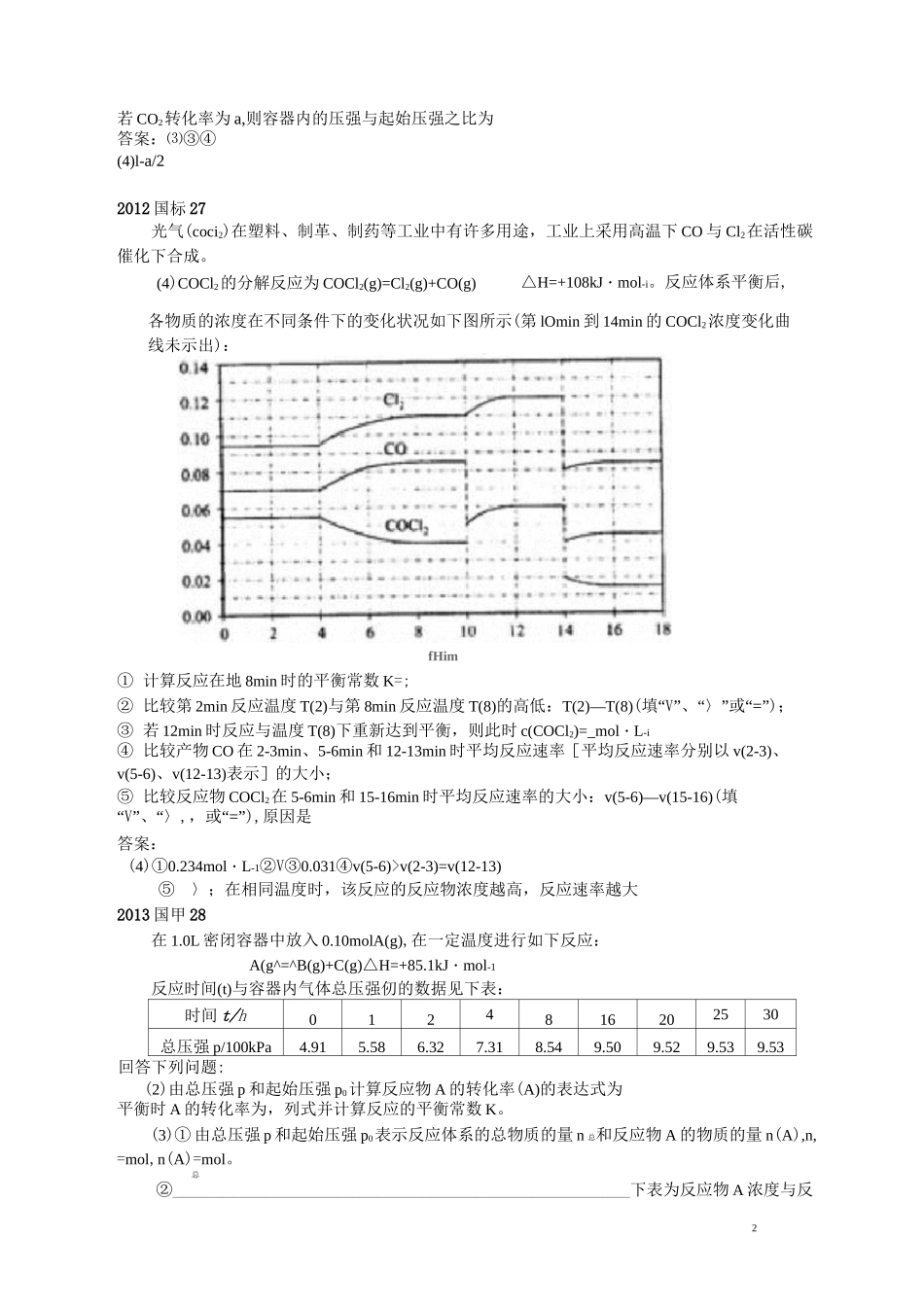
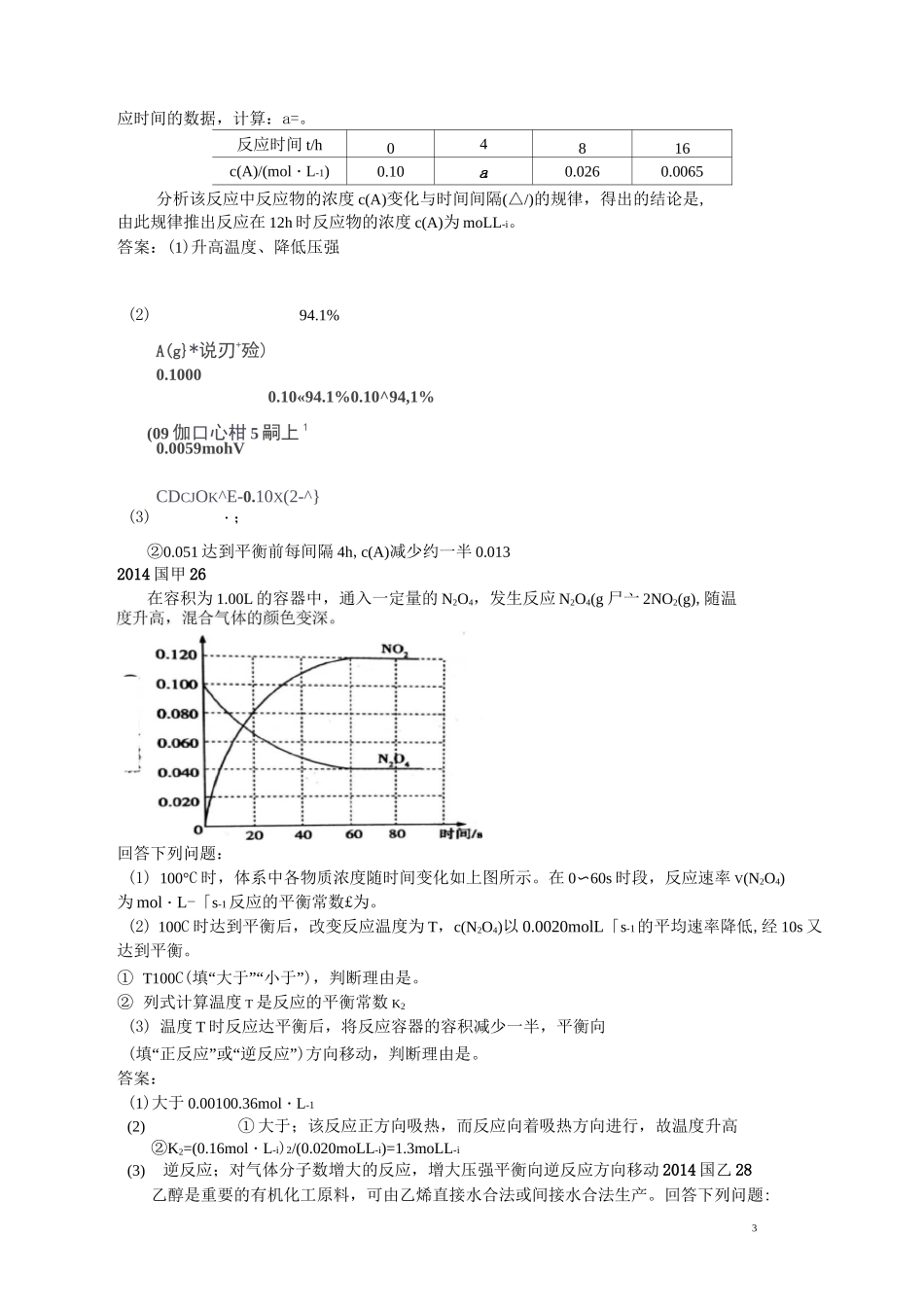
1全国卷“速率与平衡的计算”考点的分析与建议广州大学附属中学方军一、全国卷“速率与平衡的计算”考点的试题2010 国标 26物质 A〜G 有下图所示转化关系(部分反应物、生成物没有列出)。其中 A 为某金属矿的主要成分,经过一系列反应可得到 B 和 C。单质 C 可与 E 的浓溶液发生反应,G 为砖红色沉淀。A—(4)将 0.23molB 和 0.11mol 氧气放入容积为 1L 的密闭容器中,发生反应①,在一定温度下,反应达到平衡,得到 0.12molD,则反应的平衡常数 K=。若温度不变,再加入 0.50mol 氧气后重新达到平衡,则 B 的平衡浓度(填“增大”、“不变”或“减小”),氧气的转化率(填“升高”、“不变”或“降低”),D 的体积分数(填“增大”、“不变”或“减小”)。答案:(4)k=23.8L・mol-1减小降低减小2011 国标 27科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知 H2(g)、CO(g)和 CH3OH(l)的燃烧热 AH 分别为-285.8kJ・mol-1、-283.0kJ・mol-1和-726.5kJ・mol-1。请回答下列问题:(3)在容积为 2L 的密闭容器中,由 CO2和 H2合成甲醇,在其他条件不变得情况下,考查温度对反应的影响,实验结果如下图所示(注:T]、T2均大于 300D;下列说法正确的是(填序号);① 温度为 T1时,从反应开始到反应达到平衡,生成甲醇的平均速率为 v(CH3OH)=nA/tAmoLL-1•min-1② 该反应在 T1时的平衡常数比 T2时的小③ 该反应为放热反应④ 处于 A 点的反应体系从 T1变到 T2,达到平衡时心込。增大(4)在 T1温度时,将 1molCO2和 3molH2充入一密闭恒容容器中,充分反应达到平衡后,广回AT.t)Tip\2若 CO2转化率为 a,则容器内的压强与起始压强之比为答案:⑶③④(4)l-a/22012 国标 27光气(coci2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下 CO 与 Cl2在活性碳催化下合成。△H=+108kJ・mol-i。反应体系平衡后,① 计算反应在地 8min 时的平衡常数 K=;② 比较第 2min 反应温度 T(2)与第 8min 反应温度 T(8)的高低:T(2)—T(8)(填“V”、“〉”或“=”);③ 若 12min 时反应与温度 T(8)下重新达到平衡,则此时 c(COCl2)=_mol・L-i④ 比较产物 CO 在 2-3min、5-6min 和 12-13min 时平均反应速率[平均反应速率分别以 v(2-3)、v(5-6)、v(12-13)表示]的大小;⑤ 比较反应物 COCl2在 5-6min 和 15-16min 时平均反应速...