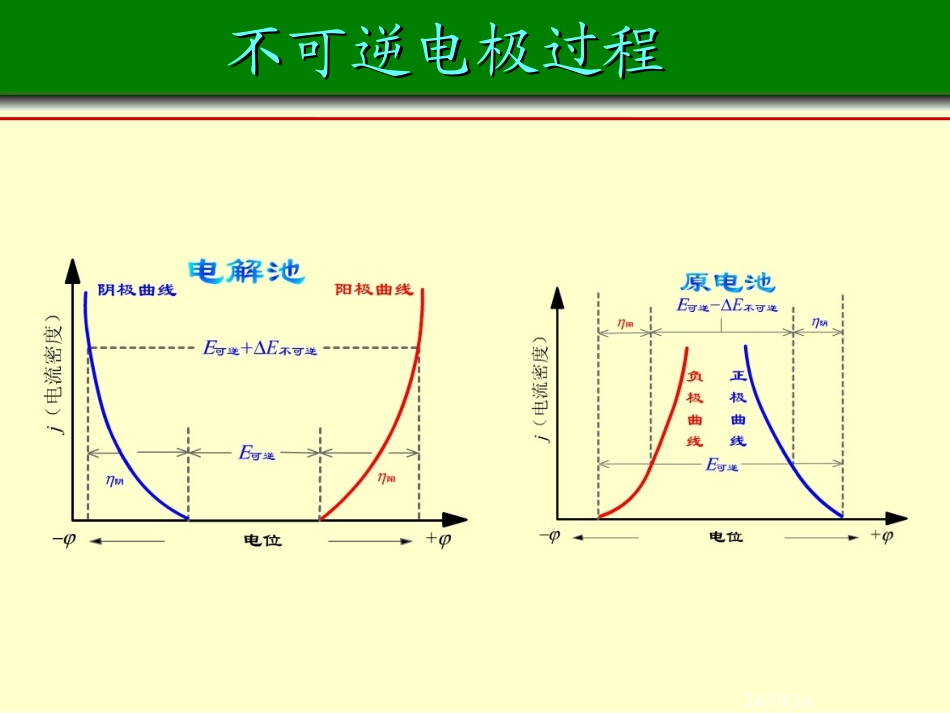
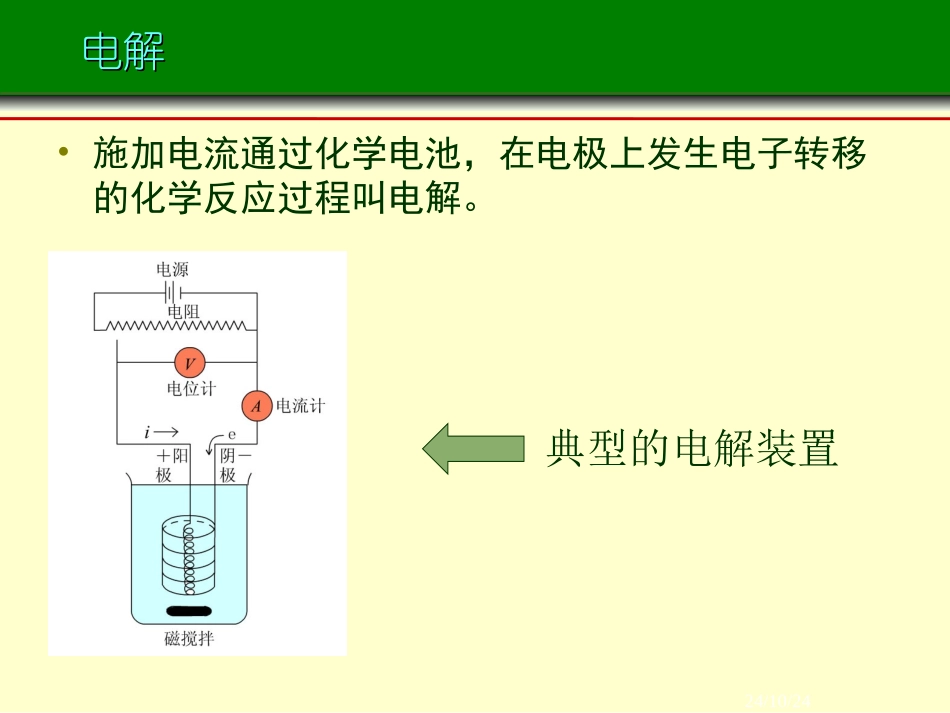
24/10/24不可逆电极过程不可逆电极过程24/10/24不可逆电极过程不可逆电极过程1分解电压2极化作用3电解时电极上的反应4金属的电化学腐蚀与防腐5化学电源24/10/24电解电解•施加电流通过化学电池,在电极上发生电子转移的化学反应过程叫电解。典型的电解装置24/10/24电解电解构成电解池的条件:是电能转变为化学能的装置!①直流电源;与电源负极相连的电极为阴极与电源正极相连的电极为阳极②阴、阳电极③电解质溶液或熔融电解质;24/10/24电解池的工作原理电解池的工作原理电子从电源负极给出电子进入电解池的阴极阳离子得电子(发生还原反应)阳离子移向阴极阴离子移向阳极电子流回电源正极阴离子失电子(或非惰性电极发生氧化反应)电子从电解池的阳极流出24/10/24Cu2+oooooooooooooooooooo-+-+阴极阳极CuCl2ClCloooooooooooooooooooooooe-e-单击电子流动电解氯化铜溶液实验装置24/10/2411理论分解电压理论分解电压理论分解电压使某电解质溶液能连续不断发生电解时所必须外加的最小电压,在数值上等于该电解池作为可逆电池时的可逆电动势()()EE理论分解可逆24/10/24分解电压的测定分解电压的测定使用Pt电极电解H2O,加入中性盐用来导电,实验装置如图所示。逐渐增加外加电压,由安培计G和伏特计V分别测定线路中的电流强度I和电压E,画出I-E曲线。24/10/24分解电压的测定分解电压的测定外加电压很小时,几乎无电流通过,阴、阳极上无H2气和氧气放出。随着E的增大,电极表面产生少量氢气和氧气,但压力低于大气压,无法逸出。所产生的氢气和氧气构成了原电池,外加电压必须克服这反电动势,继续增加电压,I有少许增加,如图中1-2段。24/10/24分解电压的测定分解电压的测定当外压增至2-3段,氢气和氧气的压力等于大气压力,呈气泡逸出,反电动势达极大值Eb,max。再增加电压,使I迅速增加。将直线外延至I=0处,得E(分解)值,这是使电解池不断工作所必需外加的最小电压,称为分解电压。24/10/24实际分解电压实际分解电压()()()()(())EEEIRE分解可逆不阳可逆不可逆阴要使电解池顺利地进行连续反应,除了克服作为原电池时的可逆电动势外,还要克服由于极化在阴、阳极上产生的超电势和,以及克服电池电阻所产生的电位降。这三者的加和就称为实际分解电压。()阳()阴IR显然分解电压的数值会随着通入电流强度的增加而增加。24/10/2422极化作用极化作用极化(polarization)当电极上无电流通过时,电极处于平衡状态,这时的电极电势分别称为阳极平衡电势和阴极平衡电势。()E阳,平()E阴,平在有电流通过时,随着电极上电流密度的增加,电极实际分解电势值对平衡值的偏离也愈来愈大,这种对平衡电势的偏离称为电极的极化。24/10/24极化的类型极化的类型根据极化产生的不同原因,通常把极化大致分为两类:浓差极化和电化学极化。(1)浓差极化在电解过程中,电极附近某离子浓度由于电极反应而发生变化,本体溶液中离子扩散的速度又赶不上弥补这个变化,就导致电极附近溶液的浓度与本体溶液间有一个浓度梯度,这种浓度差别引起的电极电势的改变称为浓差极化。用搅拌和升温的方法可以减少浓差极化。24/10/24浓差极化浓差极化•以锌电极为例:•阴极反应:Zn2++2e-→Zn•(298K)•溶液中电极附近的锌离子首先到电极上去反应,若溶液内部的离子来不及扩散到电极附近,将造成电极附近浓度底于溶液内部体相浓度,使电极电势偏离平衡电极电势。)Zn(1lg205916.02aEE24/10/24浓差极化浓差极化)Zn(1lg205916.02表aEEi(298K)由于a表<a本)Zn(1lg205916.02aEE∴Ei<Er因为存在浓差极化,此时24/10/24极化的类型极化的类型(2)电化学极化电极反应总是分若干步进行,若其中一步反应速率较慢,需要较高的活化能,为了使电极反应顺利进行所额外施加的电压称为电化学超电势(亦称为活化超电势),这种极化现象称为电化学极化。24/10/24超电势超电势((overpotentialoverpotential))在某一电流密度下,实际发生电解的电极电势与平衡电极电势之间的差值称为超电势。()E不可逆为了使超电势都是正值,把阴极超电势和阳极超电势分别定义为:()阴()阳(,...