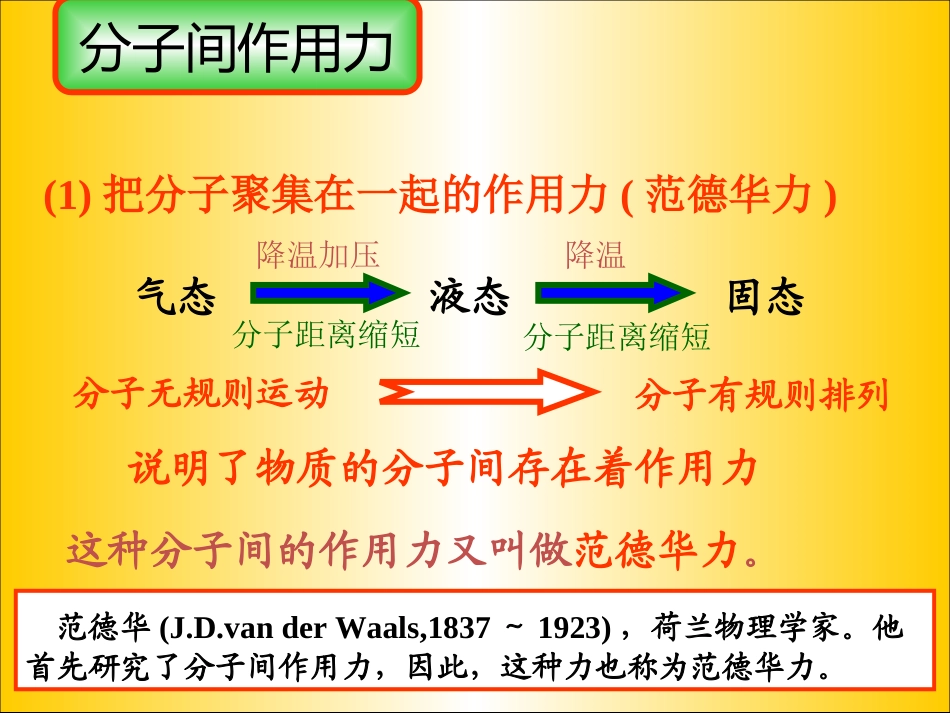
分子间作用力分子晶体一、分子间作用力1.概念:将气体分子凝聚成相应的固体或液体的作用。3.类型:常见的分子间作用力:范德华力和氢键2.实质:分子间作用力是一种静电作用,但比化学键弱得多分子间作用力说明了物质的分子间存在着作用力这种分子间的作用力又叫做范德华力。范德华(J.D.vanderWaals,1837~1923),荷兰物理学家。他首先研究了分子间作用力,因此,这种力也称为范德华力。气态液态固态降温加压降温分子距离缩短分子距离缩短分子无规则运动分子有规则排列(1)把分子聚集在一起的作用力(范德华力)。分子间存在作用力的事实:由分子构成的物质,在一定条件下能发生三态变化,说明分子间存在作用力。范德华力化学键存在于何种微粒之间相互作用的强弱分子与分子间的作用力相邻原子间的相互作用弱(几到几十kJ/mol)强(120~800kJ/mol)HCl分子中,H-Cl键能为431kJ/mol,HCl分子间,分子间的作用力为21kJ/mol。分子间作用力与化学键的区别:二、范德华力1.存在:范德华力普遍存在固体、液体、和气体分子间2.方向性与饱和性:范德华力一般没有方向性、饱和性,只要分子周围空间准许,当气体分子凝聚时,它总是尽可能吸引更多的其它分子3.影响范德华力的因素影响范德华力的因素很多:分子的大小、分子的空间构型、分子中的电荷分布情况4.范德华力与物质性质的关系对于分子构成的物质,范德华力影响物质的熔、沸点、溶解度例:氧气在水中的溶解度比氮气大,原因是氧分子与水分子之间的范德华力大几种类型的范德华力(P50)交流与讨论:根据卤素单质的熔、沸点的变化规律,分析对物质熔、沸点的影响卤素单质熔沸点与相对分子质量的关系分子间作用力对物质的熔点、沸点的影响组成和结构相似的物质,相对分子质量越大,分子间作用力越大,克服分子间引力使物质熔化和气化就需要更多的能量,熔、沸点越高。沸点熔点四卤化碳熔沸点与相对分子质量的关系溶质分子与溶剂分子间的范德华力越大,则溶质分子的溶解度越大,如CH4和HCl在水中的溶解情况,由于CH4和H2O分子间的作用力很小,故CH4几乎不溶于水,而HCl与H2O分子间的作用力较大,故HCl极易溶于水;同理,Br2、I2与苯分子间的作用力较大,故Br2、I2易溶于苯中,而H2O与苯分子问的作用力很小,故H2O很难溶于苯中。相似相溶原理:由极性分子组成的溶质易溶解于极性分子的溶剂之中;非极性分子组成的溶质易溶于非极性分子组成的溶剂之中.对溶解度的影响:课堂练习比较下列物质的熔沸点的高低CH4_CF4_CCl4_CBr4_CI4H2O_H2S_H2Se_H2Te<<<<<<<联系生活实际?你能发现出什么矛盾吗?H2OH2SH2SeH2TeHFHClHBrHINH3PH3AsH3SbH3CH4SiH4GeH4SnH4一些氢化物的沸点三、氢键1.氢键的形成过程在水分子中的O—H中,共用电子对强烈的偏向氧原子,使得氢原子几乎成为“裸露”的质子,其显正电性,它能与另一个水分子中氧原子的孤电子对产生静电作用,从而形成氢键。水分子间形成的氢键水分子三态与氢键的关系HFδ+δ-HFδ-δ+HFδ-δ+在HF分子中,由于F原子吸引电子的能力很强,H—F键的极性很强,共用电子对强烈地偏向F原子,亦即H原子的电子云被F原子吸引,使H原子几乎成为“裸露”的质子。这个半径很小、带部分正电荷的H核,与另一个HF分子带部分负电荷的F原子相互吸引。这种静电吸引作用就是氢键。2、氢键形成条件故只有部分分子之间才存在氢键,如HF、H2O、NH3分子之间存在氢键。如H2O中,H-O中的共用电子对强烈的偏向氧原子,使氢原子几乎成为“裸露”的质子。便与另一个水分子带部分负电荷的氧原子相互吸引。这种静电吸引作用就是氢键。3.氢键的表示方法:X——H···Y化学键氢键强烈、距离近微弱、距离远X、Y两原子可以相同氢键不是化学键,为了与化学键相区别。H一X…Y—H中用“…”来表示氢键.注意三个原子(H—X…Y)要在同一条直线上(X、Y可相同或不同)。5.氢键的类型:(1).分子间氢键(2).分子内氢键F——H····F——HOOHCOH4.氢键的方向性与饱和性:氢键具有方向性与饱和性6.氢键对物质性质的影响(1).氢键对物质溶、沸点的影响分子间氢键增大了分子间的作用力使物质的溶、沸点升高。所以对羟基苯甲酸高于邻羟基苯甲酸分子...