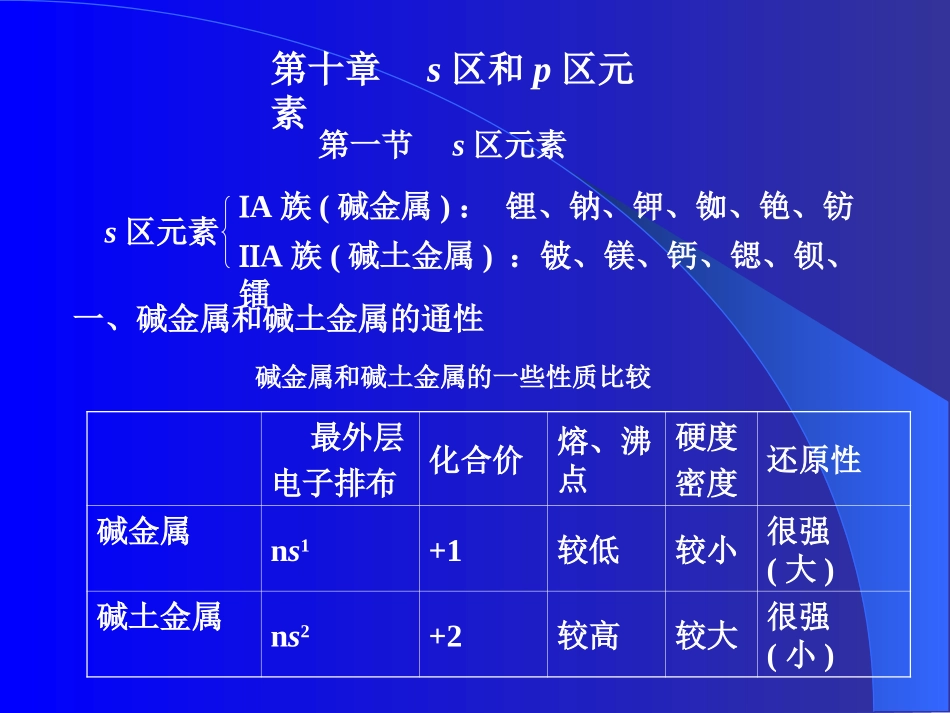
第十章s区和p区元素s区元素A族(碱金属):锂、钠、钾、铷、铯、钫A族(碱土金属):铍、镁、钙、锶、钡、镭第一节s区元素一、碱金属和碱土金属的通性最外层电子排布化合价熔、沸点硬度密度还原性碱金属ns1+1较低较小很强(大)碱土金属ns2+2较高较大很强(小)碱金属和碱土金属的一些性质比较二、碱金属和碱土金属的化合物1、氢化物2M+H2=2MH(M=碱金属)M+H2=MH2(M=Ca、Sr、Ba)氢化物均为白色盐状的离子晶体,其中含有的离子为H-离子。它们都是强还原剂和优良的氢气发生剂。NaH+H2O=NaOH+H2CaH2+2H2O=Ca(OH)2+2H22、氧化物(1)普通氧化物a制备碱金属:Na2O2+2Na=2Na2O2KNO3+10K=6K2O+N2★Li+O2=Li2O燃烧△碱土金属:CaCO3=CaO+CO22Sr(NO3)2=2SrO+4NO2+O2△2Mg+O2=2MgO燃烧b与水反应:M2O+H2O=2MOH(M=碱金属)2MO+H2O=2M(OH)2(M=碱土金属)★同主族A和A族元素随着原子序数的递增,其氧化物与水反应的能力依次增大。(2)过氧化物过氧离子:O22-[—O—O—]2-bBaO2+H2SO4=H2O2+BaSO4(H2O2的实验室制法)aNa2O2+2H2O=H2O2+2NaOHNa2O2+H2SO4=H2O2+Na2SO42H2O2=2H2O+O22Na2O2+CO2=Na2CO3+O2as,sp区金属氢氧化物在空气中与CO2反应生成碳酸盐。b同族,这些氢氧化物碱性自上而下递增。如:LiOHHCl>HBr>HI2HBr+H2SO4(浓)=Br2+SO2+2H2O8HI+H2SO4(浓)=4I2+H2S+4H2O(3)特殊反应:SiO2+4HF=SiF4+2H2O◆氢氟酸不宜贮存于玻璃器皿中,应盛于塑料容器里。(2)氢卤酸都是强酸(氢氟酸除外)。酸性、还原能力:HFFeCl3。b卤素离子的大小和变形性对金属卤化物的性质影响较大。如:共价程度:AgI>AgBr>AgCl>AgF(1)KI+I2KI3次卤酸(HXO)亚卤酸(HXO2)卤酸(HXO3)高卤酸(HXO4)离子构型:XO-—直线形XO2-—角形XO3-—三角锥形XO4-—四面体形热稳定性:XO-HBrO>HIOb次卤酸极不稳定,室温分解的两种方式为:c碱性介质中,卤素单质、次卤酸均可发生歧化反应;酸性介质中,仅次卤酸发生歧化反应。2HXO2HX+...