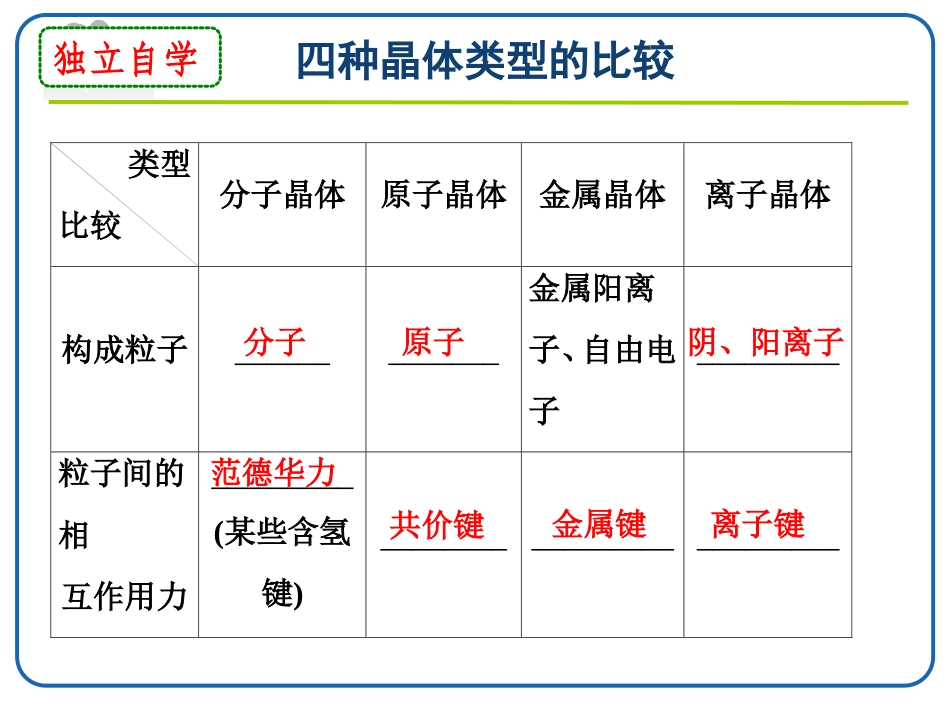
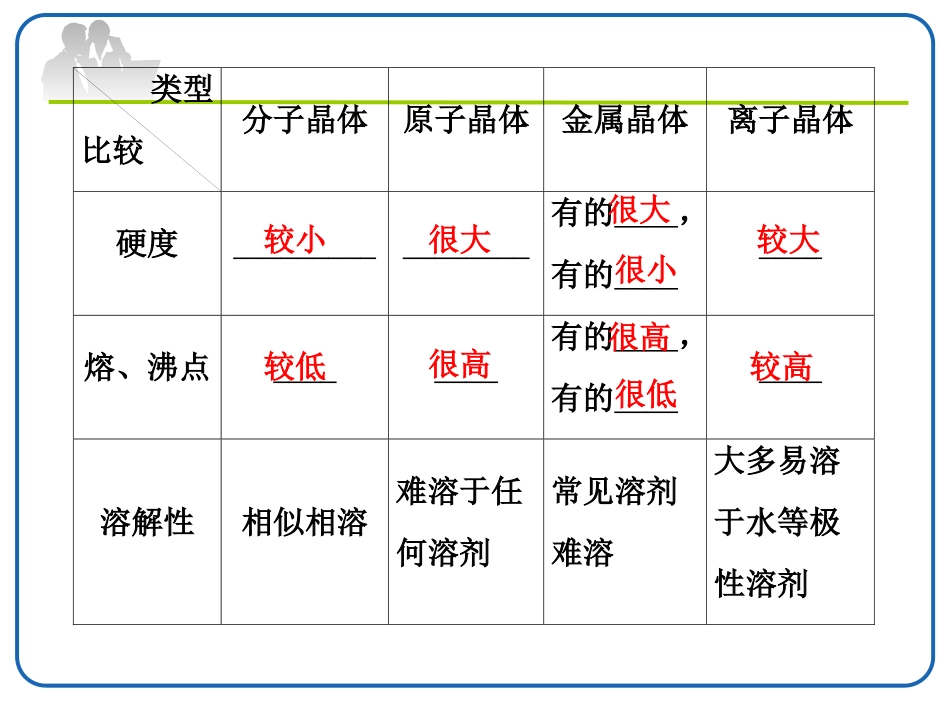
晶体的熔、沸点比较独立自学四种晶体类型的比较类型比较分子晶体原子晶体金属晶体离子晶体构成粒子_____________金属阳离子、自由电子_________粒子间的相互作用力_________(某些含氢键)__________________________分子原子阴、阳离子范德华力共价键金属键离子键类型比较分子晶体原子晶体金属晶体离子晶体硬度_________________有的____,有的________熔、沸点________有的____,有的________溶解性相似相溶难溶于任何溶剂常见溶剂难溶大多易溶于水等极性溶剂较小很大很大很小较大较低很高很高很低较高类型比较分子晶体原子晶体金属晶体离子晶体导电、传热性一般不导电,溶于水后有的导电一般不具有导电性,个别为半导体电和热的良导体晶体不导电,水溶液或熔融态导电物质类别及举例大多数非金属单质、气态氢化物、酸、非金属氧化物(SiO2除外)、绝大多数有机物(有机盐除外)部分非金属单质(如金刚石、硅、晶体硼),部分非金属化合物(如SiC、SiO2)金属单质与合金(如Na、Al、Fe、青铜)金属氧化物(如K2O、Na2O)、强碱(如KOH、NaOH)、绝大部分盐(如NaCl)判断晶体类型的五个依据1.构成晶体的微粒和微粒间的作用力;2.物质的类别;3.晶体的熔点;4.物质的导电性;5.硬度和机械性能。引导探究1、不同状态物质晶体熔、沸点的比较在相同条件下,不同状态物质的熔、沸点高低是不同的,一般有固体>液体>气体晶体熔沸点的比较例如:KBr(固体)>Br2(液体)>HBr(气体)引导探究2、不同类型晶体熔、沸点的比较(1)不同类型晶体的熔、沸点高低的一般规律:__________>____________>__________。(2)金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。原子晶体离子晶体分子晶体晶体熔沸点的比较注:判断晶体熔沸点高低时应首先分析晶体类别。3、同种晶体类型熔、沸点的比较(1)原子晶体:相邻原子之间只通过强烈的共价键结合而成的空间网状结构的晶体叫做原子晶体。所以原子晶体的融化和汽化时原子间的共价键会断裂,其熔沸点高低由共价键的强弱决定。原子半径越__―→键长越__―→键能越__―→熔沸点越__如熔点:金刚石___碳化硅____硅。小短大高>>原子晶体金刚石氮化硼碳化硅石英硅锗熔点/0C>355030002700171014101211硬度109.59.576.56.0引导探究(2)离子晶体:a.一般地说,阴、阳离子的电荷数越____,离子半径越___,则离子间的作用力就越___,其离子晶体的熔、沸点就越___,如熔点:MgO___MgCl2____NaCl____CsCl。b.衡量离子晶体稳定性的物理量是晶格能。晶格能越___,形成的离子晶体越_____,熔点越____,硬度越____。多小强高>>>大稳定高大(3)分子晶体:a.分子间作用力越___,物质的熔、沸点越___;具有氢键的分子晶体熔、沸点反常地。如H2O___H2Te___H2Se__H2S。b.组成和结构相似的分子晶体,相对分子质量越___,熔、沸点越高,如SnH4____GeH4____SiH4____CH4。大高>>>高大>>>【注意】1、分子间作用力包括和;2、分子晶体汽化或熔融时破坏的作用力。范德华力氢键分子间作用力c.组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高,如CO>N2,CH3OH>CH3CH3。d.同分异构体,支链越多,熔、沸点越低。④金属晶体:金属离子半径越小,离子电荷数越多,其金属键越强,金属熔、沸点就越高,如熔、沸点:Na<Mg<Al。注:①一般来说,分子晶体中范德华力越大,物质的熔、沸点越高。②分子间氢键的形成使物质的熔、沸点升高;分子内氢键的形成使物质的熔、沸点降低。(4)金属晶体熔点变化规律①金属晶体熔点变化较大与金属晶体紧密堆积方式、金属阳离子与自由电子之间的金属键的强弱有密切关系.熔点最低的金属:汞(常温时成液态)熔点很高的金属:钨(3410℃)铁的熔点:1535℃②一般情况下,金属晶体熔点由金属键强弱决定:金属阳离子半径越小,所带电荷越多,自由电子越多,金属键越强,熔点就相应越高,硬度也越大,但金属性越弱。如:KNaMgAlLiNaKRbCs﹥﹥﹥﹥﹤﹤﹤合金的熔、沸点一般比它各组分的熔、沸点低。1.硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系...