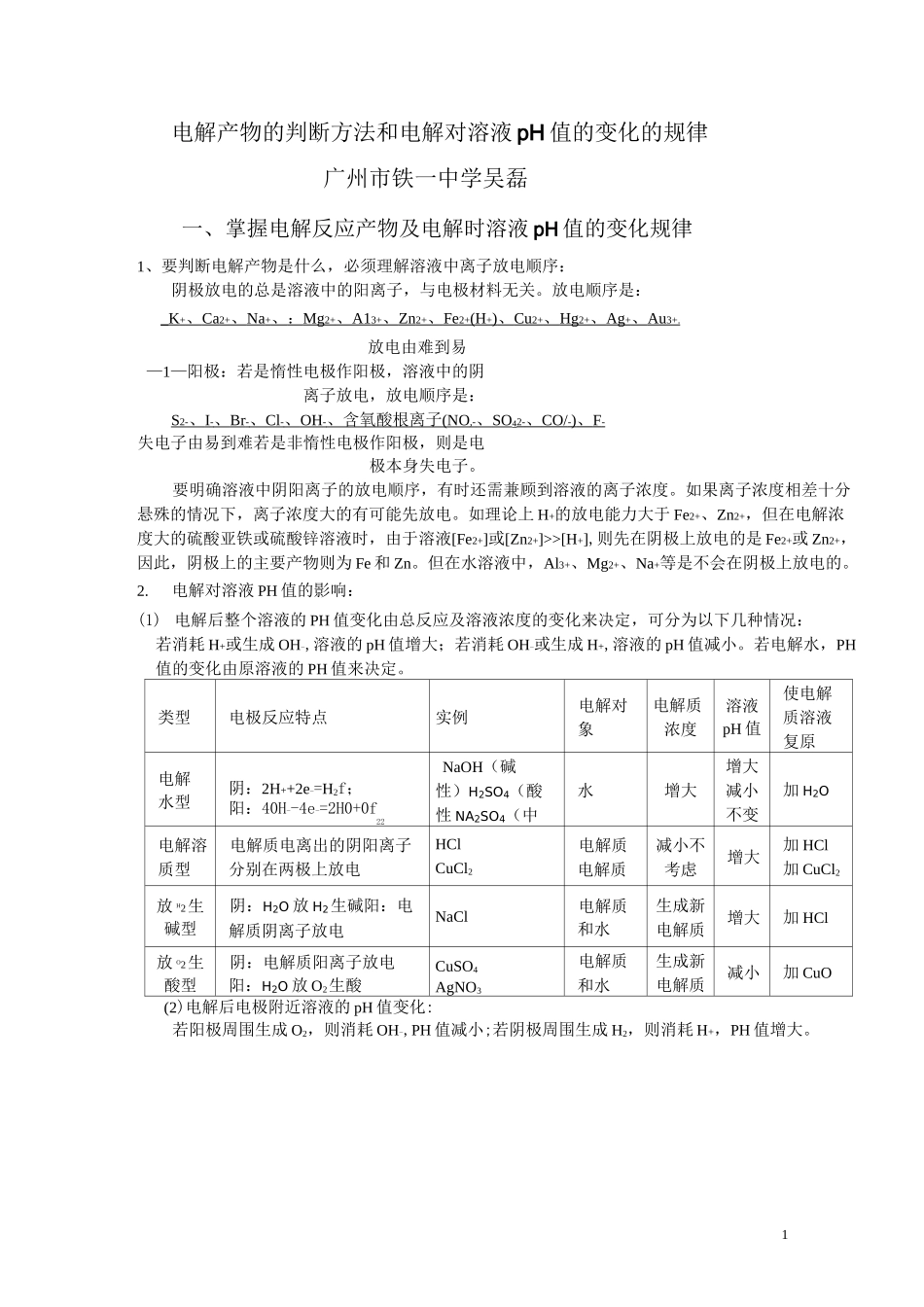
1电解产物的判断方法和电解对溶液 pH 值的变化的规律广州市铁一中学吴磊一、掌握电解反应产物及电解时溶液 pH 值的变化规律1、要判断电解产物是什么,必须理解溶液中离子放电顺序:阴极放电的总是溶液中的阳离子,与电极材料无关。放电顺序是:_ K + 、 Ca 2+ 、 Na + 、 : Mg 2+ 、 A1 3+ 、 Zn 2+ 、 Fe 2+ (H + ) 、 Cu 2+ 、 Hg 2+ 、 Ag + 、 Au 3+. 放电由难到易—1—阳极:若是惰性电极作阳极,溶液中的阴离子放电,放电顺序是:S 2- 、 I - 、 Br - 、 Cl - 、 OH - 、含氧酸根离子 (NO ,- 、 SO 42- 、 CO/ - ) 、 F - 失电子由易到难若是非惰性电极作阳极,则是电极本身失电子。要明确溶液中阴阳离子的放电顺序,有时还需兼顾到溶液的离子浓度。如果离子浓度相差十分悬殊的情况下,离子浓度大的有可能先放电。如理论上 H+的放电能力大于 Fe2+、Zn2+,但在电解浓度大的硫酸亚铁或硫酸锌溶液时,由于溶液[Fe2+]或[Zn2+]>>[H+],则先在阴极上放电的是 Fe2+或 Zn2+,因此,阴极上的主要产物则为 Fe 和 Zn。但在水溶液中,Al3+、Mg2+、Na+等是不会在阴极上放电的。2.电解对溶液 PH 值的影响:(1) 电解后整个溶液的 PH 值变化由总反应及溶液浓度的变化来决定,可分为以下几种情况:若消耗 H+或生成 OH-,溶液的 pH 值增大;若消耗 OH-或生成 H+,溶液的 pH 值减小。若电解水,PH值的变化由原溶液的 PH 值来决定。类型电极反应特点实例电解对象电解质浓度溶液pH 值使电解质溶液复原电解水型阴:2H++2e-=H2f;阳:40H--4e-=2H0+0f22NaOH(碱性)H2SO4(酸性 NA2SO4(中性)水增大增大减小不变加 H2O电解溶质型电解质电离出的阴阳离子分别在两极上放电HClCuCl2电解质电解质减小不考虑增大加 HCl加 CuCl2放 H2生碱型阴:H2O 放 H2生碱阳:电解质阴离子放电NaCl电解质和水生成新电解质增大加 HCl放 O2生酸型阴:电解质阳离子放电阳:H2O 放 O2生酸CuSO4AgNO3电解质和水生成新电解质减小加 CuO(2)电解后电极附近溶液的 pH 值变化:若阳极周围生成 O2,则消耗 OH-,PH 值减小;若阴极周围生成 H2,则消耗 H+,PH 值增大。2a 极板b 极板x 电极Z 溶液A锌石墨负极CuSO4B石墨石墨负极NaOHC银铁正极AgNO3D铜石墨负极CUC12a「 -|r^ibGni———-■Jd-J-'ItAgNO3溶薇 5.00%H2S04二、例题分析例 1、以石墨棒为电极电解硝酸铜水溶液,写出电...