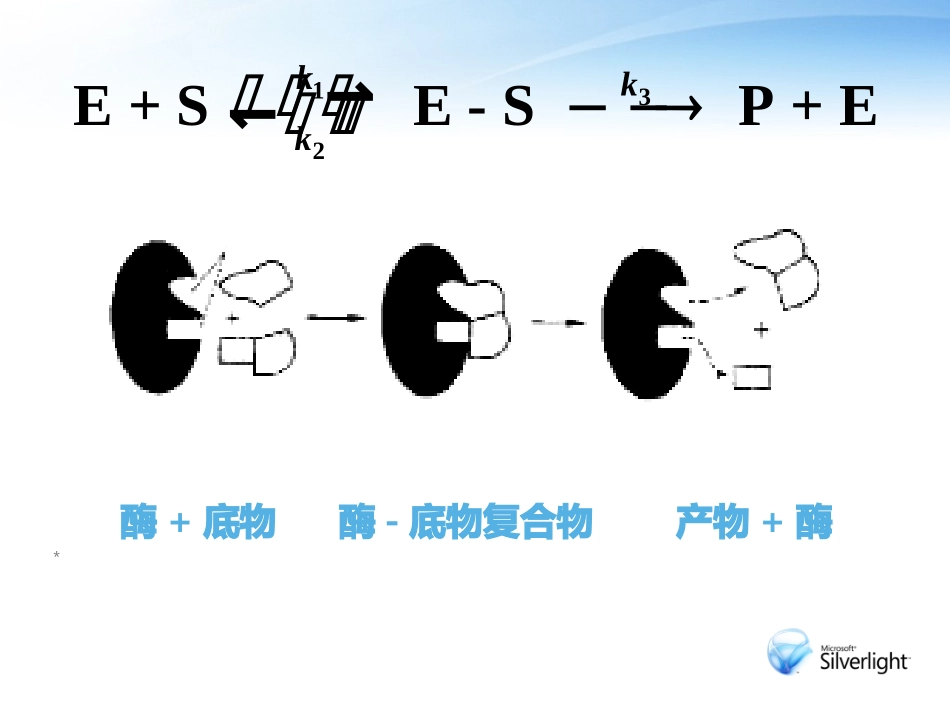
酶与底物分子的相互作用4.4.3酶+底物酶-底物复合物产物+酶*132E+SE-SP+Ekkk在反应中,E与S通过某种方式结合形成ES时,使底物分子内某些化学键呈不稳定状态,从而降低了活化能。ES复合物还可转变为酶与产物的复合物EP,继而EP分解出P和E。ES复合物的形成是决定反应速率的关键步骤。许多实验事实证明了ES复合物的存在,如:已获得ES结晶、X线衍射法描出ES图象、同位素标记底物实验、光谱分析分析132E+SE-SP+Ekkk酶和底物之间结合的作用力静电引力—酶分子中带正或负电荷的基团与底物分子中带相反电荷的基团相互作用该作用力大小与正负电荷量成正比,与介电常数成反比,在疏水环境比在亲水环境中更强。氢键键能高、有方向性能诱导底物基团的价键状态发生变形和极化酶和底物之间结合的作用力疏水键蛋白质分子侧链含大量亲水性和疏水性基团。酶分子的活性中心处于一定程度的疏水环境。活性中心的疏水键与底物分子的疏水部分结合,并且能够维持活性中心空间结构稳定性。酶和底物之间结合的作用力此外,微环境也会影响酶和底物的结合酶活性中心处于一个非极性环境中,从而有利于同底物的结合。(水的极性和形成氢键的能力都较强,能够减弱极性基团间的相互作用)酶和底物分子相互作用的形式及意义(1)邻近效应与定向效应(2)与过渡态的结合作用(3)多功能催化作用(4)酶催化作用学说①锁钥学说②诱导契合学说③三点结合理论邻近效应与定向效应邻近效应与定向效应变分子间反应为分子内反应。酶把底物分子从溶液中富集出来,使它们固定在活性中心附近,反应基团相互邻近,同时使反应基团的分子轨道以正确方位相互交叠,反应易于发生。邻近效应邻近效应(Proximityeffect)酶与底物形成中间复合物后使底物之间、酶的催化基团与底物之间相互靠近,提高了反应基团的有效浓度,使反应速率大大增加。邻近效应咪唑催化对硝基苯酯的水解,分子内反应比分子间反应快24倍。说明咪唑基与酯基的相对位置对反应速率影响很大定向效应定向效应(Orientationeffect)由于酶的构象作用,当底物和酶的反应中心结合后,在酶的反应中心活性基团的作用和诱导下,使底物的反应基团按照最佳方式定向和定位,大大增加反应速率。反应基团定向和定向程度越高,反应速率越大。反之,反应基团定位程度低,则反应速率减小。邻近定向效应小结邻近定向效应是指两种或两种以上的底物(特别是双底物)同时结合在酶活性中心上,相互靠近(邻近),并采取正确的空间取向(定向),这样大大提高了底物的有效浓度,使分子间反应近似分子内反应从而加快了反应速度,可使双分子反应速率提高104~108倍。底物与活性中心的结合不仅使底物与酶催化基团或其它底物接触,而且强行“冻结”了底物的某些化学键的平动和转动,促使它们采取正确的方向,有利于键的形成。与反应过渡态结合作用按SN2历程进行的反应,反应速度与形成的过渡状态稳定性密切相关。在酶催化的反应中,与酶的活性中心形成复合物的实际上是底物形成的过渡状态酶与过渡状态的亲和力要大于酶与底物或产物的亲和力。与反应过渡态结合作用张力学说许多情况下,过渡态的形成与底物分子内的价键张力有关当R=CH3时,其反应速度比R=H的情况快315倍。由于-CH3体积比较大,与反应基团之间产生一种立体排斥张力,从而使反应基团之间更容易形成稳定的五元环过渡状态。与反应过渡态结合作用根据过渡态的结构设计的过渡态类似物可作为酶的强抑制剂,抑制效果远高于竞争性抑制剂。利用过渡态类似物作为抗原或半抗原,去免疫动物,由此产生的抗体可能有类似酶的催化作用。酶与过渡态的结合主要有两种方式:非共价结合方式和共价结合方式,后者被称为共价催化。脯氨酸消旋酶的过渡态及其过渡态类似物抑制剂多功能催化作用酶的活性中心部位,一般含有多个起催化作用的基团,这些基团在空间有特殊的排列和取向,可以对底物价键的形变和极化及调整底物基团的位置等起到协同作用,从而使底物达到最佳反应状态。多功能催化作用多官能团相互作用可使反应速率提高在α—吡啶酮存在下,O-四甲基-D葡萄糖的变旋速率可以提高7000倍。而相同浓度...