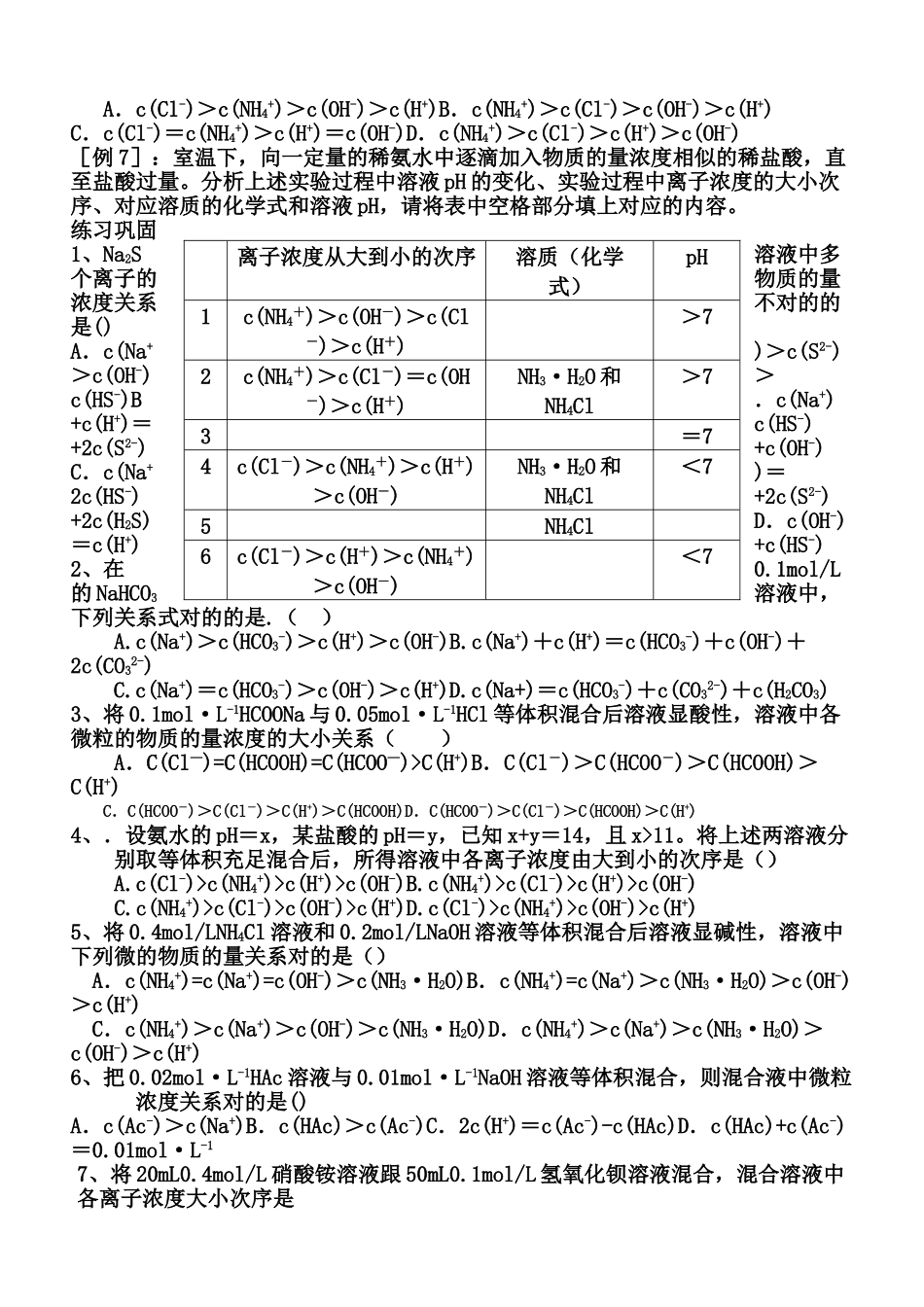
溶液中离子浓度大小比较电荷守恒 c(H+)+c(Na+)=2c(CO32-)+c(HCO3-)+c(OH-)正负电荷相等相等关系:物料守恒 c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)C 原子守恒(以 Na2CO3)质子守恒 c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)H+离子守恒离子浓度比较:①多元弱酸 H3PO4 c(H+)>c(H2PO4-)>c(HPO42-)>c(PO43-)② 多元弱酸形成的正盐 Na2CO3 c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)大小关系:③不同溶液中同一离子浓度浓度 0.1mol/L 的①、NH4Cl②、CH3COONH4③、NH4HSO4则c(NH4+)③>①>②④ 混合溶液中各离子浓度 0.1mol/LNH4Cl 与0.1mol/LNH3·H2O 混合则:c(NH4+)>c(Cl-)>c(OH-)>c(H+)1、掌握解这类题的三个思维基点:电离、水解和守恒电荷守恒:溶液中阴、阳离子所带的正、负电荷总数相等,即电解质溶液呈电中性。物料守恒:电解质溶液中某一组分的原始浓度应等于它在溶液中多个存在形式的浓度之和。质子守恒:电解质溶液中无论是水的电离、弱酸的电离还是盐类的水解,都能够当作是质子的传递过程。2、水解规律:有弱才水解,无弱不水解;越弱越水解,都弱都水解;谁强显谁性,等强显中性正盐溶液 : ① 强酸弱碱盐呈酸性②强碱弱酸盐呈碱性③强酸强碱盐呈中性④弱 酸碱盐不一定题型一:单一溶质溶液中离子浓度大小的比较:[例 1]在氯化铵溶液中,下列关系式对的的是()A.C(Cl-)>C(NH4+)>C(H+)>C(OH-)B.C(NH4+)>C(Cl-)>C(H+)>C(OH-) C.C(Cl-)=C(NH4+)>C(H+)=C(OH-)D.C(NH4+)=C(Cl-)>C(H+)>C(OH-)[例 2]在 0.1mol/l 的氨水溶液中,下列关系对的的是() A.C(NH3·H2O)>C(OH-)>C(NH4+)>C(H+)B.C(NH4+)>C(NH3·H2O)>C(OH-)>C(H+) C.C(NH3·H2O)>C(NH4+)=C(OH-)>C(H+)D.C(NH3·H2O)>C(NH4+)>C(H+)>C(OH-)练习:⑴ Na2S 溶液中各离子浓度由小到大的次序是。⑵ 同浓度的① NH3·H2O②NH4Cl③(NH4)2SO4④NH4HSO4⑤CH3COONH4溶液中的 C(NH4+)的大小 。⑶ 物质的量浓度相似的下列溶液:① Na2CO3②NaHCO3③H2CO3④(NH4)2CO3⑤NH4HCO3,按 C(CO32—)由小到大排列次序对的的是 酸式盐溶液① 若只有电离而无水解,则呈酸性(如 NaHSO4)②若现有电离又有水解,取决于两者相对大小③ 常见酸式盐溶液的酸碱性碱性:NaHCO3、NaHS、Na2HPO4、NaHS.酸性:NaHSO3、NaH2PO4、NaHSO4、NaHC2O4[例 3]:在 0.1mol·L-1的 NaHCO3溶液中,下列关系式对的的是()A.c(Na+)>c(HCO3-)>c(H+)>c(OH-)B.c(N...


 VIP
VIP VIP
VIP VIP
VIP VIP
VIP VIP
VIP VIP
VIP VIP
VIP VIP
VIP VIP
VIP VIP
VIP