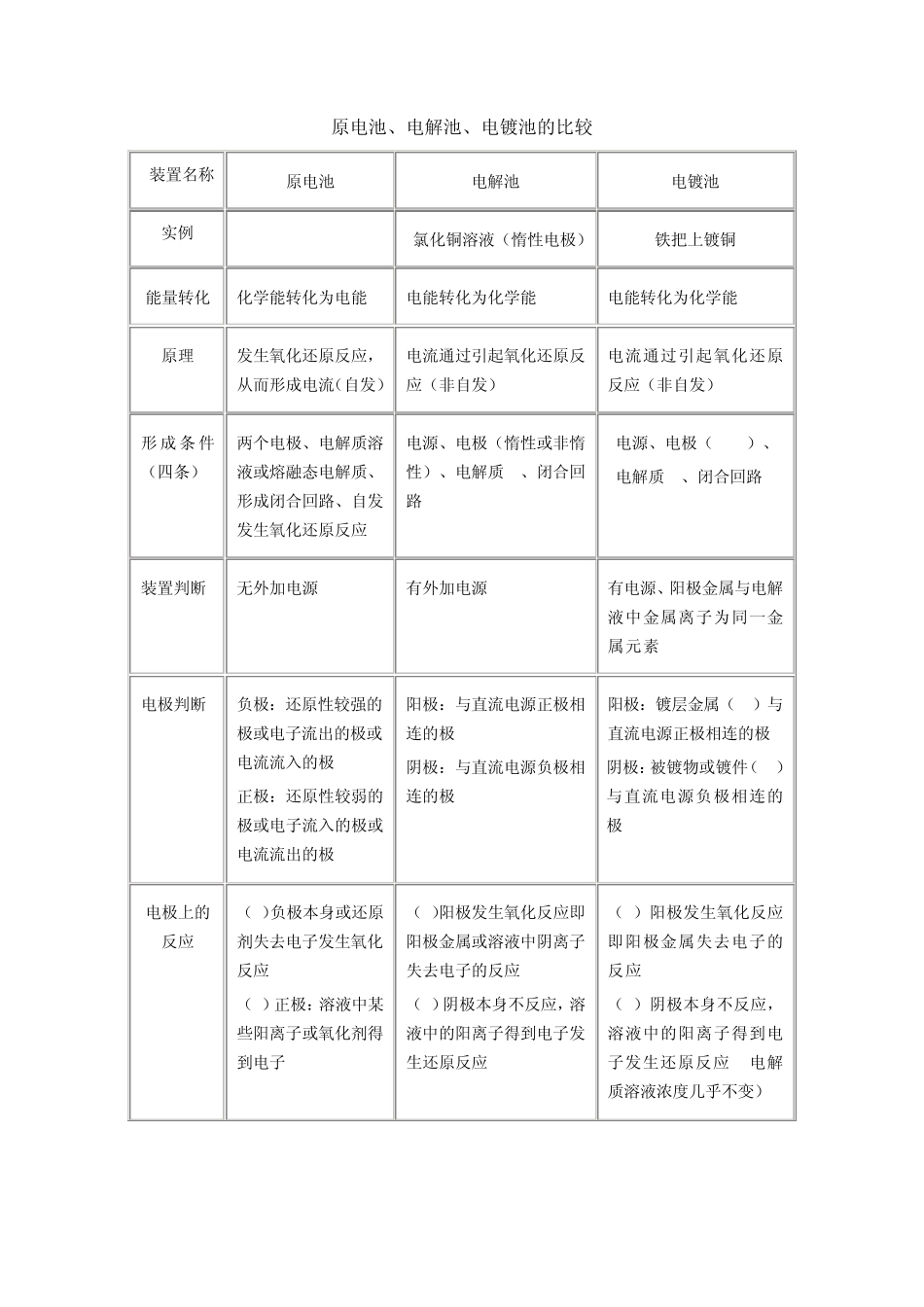
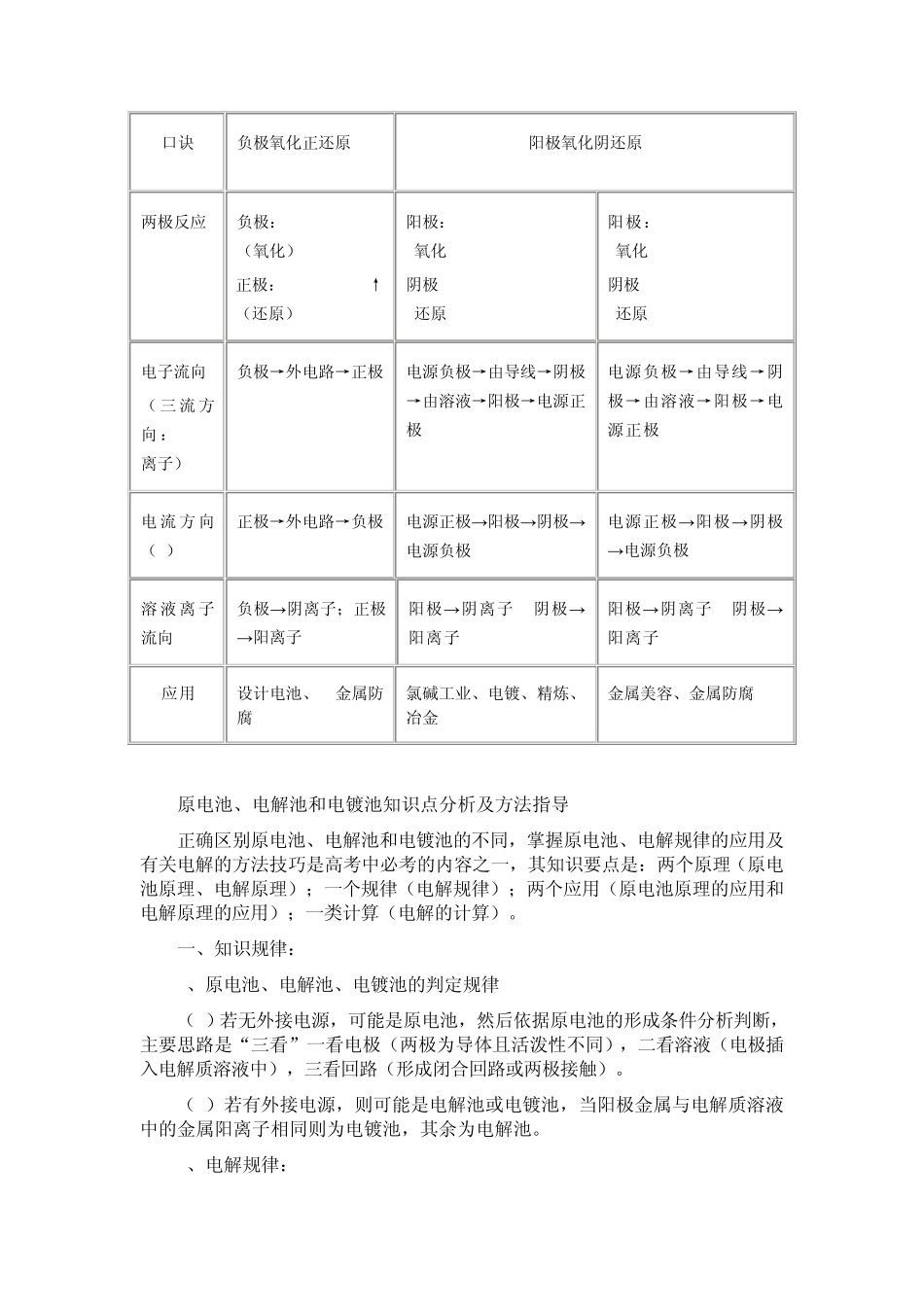
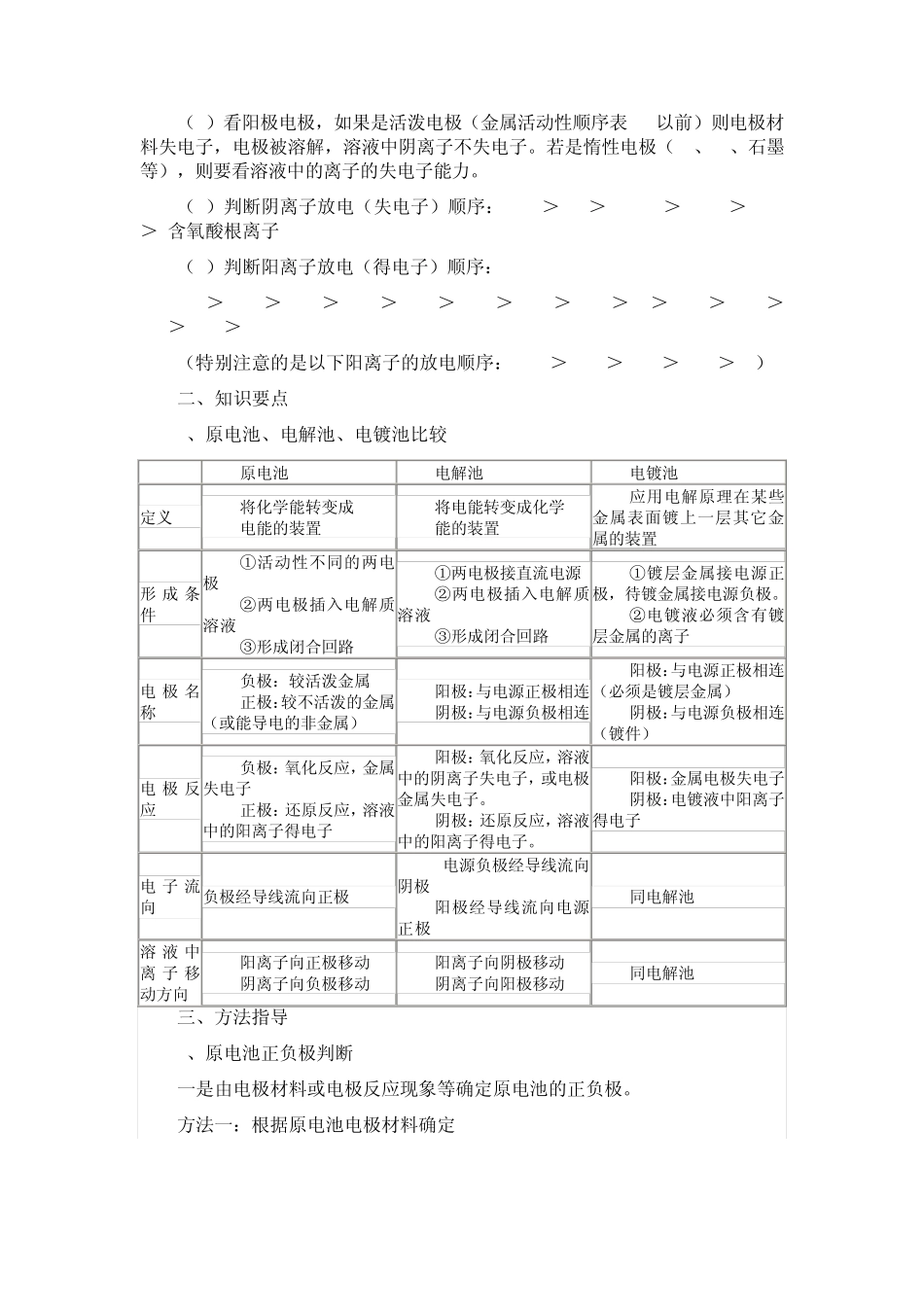
原电池、电解池、电镀池的比较 装置名称 原电池 电解池 电镀池 实例 CuZn(H2SO4) 氯化铜溶液(惰性电极) 铁把上镀铜 能量转化 化学能转化为电能 电能转化为化学能 电能转化为化学能 原理 发生氧化还原反应,从而形成电流(自发) 电流通过引起氧化还原反应(非自发) 电流通过引起氧化还原反应(非自发) 形 成 条 件(四条) 两个电极、电解质溶液或熔融态电解质、形成闭合回路、自发发生氧化还原反应 电源、电极(惰性或非惰性)、电解质 、闭合回路 电源、电极(CuFe)、 电解质 、闭合回路 装置判断 无外加电源 有外加电源 有电源、阳极金属与电解液中金属离子为同一金属元素 电极判断 负极:还原性较强的极或电子流出的极或电流流入的极 正极:还原性较弱的极或电子流入的极或电流流出的极 阳极:与直流电源正极相连的极 阴极:与直流电源负极相连的极 阳极:镀层金属(Cu)与直流电源正极相连的极 阴极:被镀物或镀件(Fe)与直流电源负极相连的极 电极上的反应 (1)负极本身或还原剂失去电子发生氧化反应 (2)正极:溶液中某些阳离子或氧化剂得到电子 (1)阳极发生氧化反应即阳极金属或溶液中阴离子失去电子的反应 (2)阴极本身不反应,溶液中的阳离子得到电子发生还原反应 (1)阳极发生氧化反应即阳极金属失去电子的反应 (2)阴极本身不反应,溶液中的阳离子得到电子发生还原反应 (电解质溶液浓度几乎不变) 口诀 负极氧化正还原 阳极氧化阴还原 两极反应 负极:Zn - 2e- =Zn2+(氧化) 正极:2H+ +2e- =H2↑(还原) 阳极:2 Cl- - 2e- = Cl2 (氧化) 阴极: Cu2+ + 2e- = Cu (还原) 阳极:Cu - 2e- = Cu2+ (氧化) 阴极: Cu2+ + 2e- = Cu (还原) 电子流向 (三流方向:e- I 离子) 负极→外电路→正极 电源负极→由导线→阴极→由溶液→阳极→电源正极 电源负极→由导线→阴极→由溶液→阳极→电源正极 电流方向(I) 正极→外电路→负极 电源正极→阳极→阴极→电源负极 电源正极→阳极→阴极→电源负极 溶液离子流向 负极→阴离子;正极→阳离子 阳极→阴离子 阴极→阳离子 阳极→阴离子 阴极→阳离子 应用 设计电池、 金属防腐 氯碱工业、电镀、精炼、冶金 金属美容、金属防腐 原电池、电解池和电镀池知识点分析及方法指导 正确区别原电池、电解池和电镀池的不同,掌握原电池、电解规律的应用及有关电解的方法技巧...